事務所からのお知らせ
-
医療機器製造販売業の更新に向けて
2022.03.23
製造販売業
製造販売業の更新に向けて
日常業務の効率化と法的リスク低減に向けて、QMS・GVPの見直し,内部点検を実施しましょう。
ここでは、更新の準備、留意事項等を解説します。
1 QMS・GVP見直しと許可更新
過去5年間の運用の「質」が問われる
医療機器の製造販売業の許可の有効期間は5年間です。
5年後には許可の更新時期を迎えることになります。
製造販売業の場合、新規申請の際には、QMS・GVPの手順書や記録様式類などは整っているか、担当者の方がQMSやGVPを運用できる状況にあるか、といったことを重点的に調査されました。
これから事業を行う上での体制が整っているかが調査の視点であったわけです。
他方、更新調査には、過去5年間、QMS・GVP省令の要求事項を満たしつつ、適切に運用がなされてきたかどうか、つまり運用の「質」を確認されることになります。
更新の手続き
許可を更新するためには、許可更新申請書の提出が必要です。
通常、製造販売業許可期限の前に、都道府県により、QMSとGVPが基準に適合していることをの調査が行われることになります。
調査時期は、早ければ半年~8か月程度前に行われている事例もあります。
2 更新準備と内部監査
年1回以上の内部監査
QMSにおいては内部監査の実施は必須です。内部監査において、適切に実施できているところを認識して維持できるようにし、不適合があれば修正するとともに原因の究明をして是正をします。内部監査を適切に計画・実施して、QMSを維持・改善してゆくようにしましょう。
QMSが適切に運用されていれば、更新調査の際に慌てることはないでしょう。
更新調査においてQMS・GVP等への適合を確認されます。
基準に適合していないと判断された場合、改善指導を受けることになります。
改善がなされるまでは、許可期限を迎えても許可の更新が出来ず、許可証が発行されないという事態を招きます。
(許可になるまで”無許可”状態が生じます)3 業務効率化と法的リスク低減
積極的に活用することで、日常業務の質向上につなげる
内部監査や、QMSの実施状況の監視は、日常業務の効率化と質の向上につなげる、よい機会であるといえます。
薬機法やQMS・GVPの再確認により、担当者の方に対する教育効果も期待できます。
QMS・GVPなどの運用は、その不適正さは行政指導や回収などの事業リスクにもつながるものです。
担当者の質の向上と平準化は、貴社のQMS・GVP運用の安定化と、要求事項かRなお逸脱のリスクを低減することにつながるでしょう。
つまり、
 法的リスクの低減
法的リスクの低減
 「人的資産」価値が向上
「人的資産」価値が向上 業務の効率化
業務の効率化といった効果が期待できるといえます。
よくある指摘事項
当事務所では、更新時期にあるかどうかにかかわらず、医療機器の製造販売業の事業者様の業務見直しを多くお手伝いして参りました。
そのなかで、しばしば見受けられる、代表的な問題点を挙げてみましょう。
(指摘事項例)
 手順書は一応存在しているが、具体性を欠く
手順書は一応存在しているが、具体性を欠く
 手順書は一応存在しているが、実態と乖離している
手順書は一応存在しているが、実態と乖離している
いずれにしても、自社の手順書である以上、具体的に、業務の実態に沿った手順書でなければ、省令要求事項に従った運用が出来ていると判断されません。新法開始当初は、東京都や大阪府、他の県庁の提示したサンプルを、ほぼそのまま「置いてある」だけの事業者様もみうけられました。御社では、市場出荷判定の流れ、製造業者との取決め・出荷管理・変更管理方法、品質・安全性情報の処理フローなど、具体的に定められていますか?
 市場出荷判定と、製造所の出荷判定が未分化
市場出荷判定と、製造所の出荷判定が未分化製造所としての判定と製造販売業の市場出荷判定を明確に意識できていないケースがまま見受けられます。製造業者に市場出荷判定を委託している製造販売業者に、しばしば見受けられる指摘事項です。製造所としての製品の合否判定(出荷判定)と、製造販売業の市場出荷判定は、別概念として分化されています。
 文書、記録類が未整備
文書、記録類が未整備手順書に規定された記録が適切でないケースも見受けられます。製造販売業において品質標準書の作成が行われていない、
製造業において製品標準書が不十分である(とくに輸入業者)
といった指摘もあります。
当事務所で手順書などの課題を洗い出し、そのうえで改善方法を検討し、お客様とともに改善を進めています。
以上のように、許可更新は申請書を提出してすぐできるものではありません。
許可更新申請のための作業や、QMS適合性調査など、年間のスケジューリングを適切に行う必要があるでしょう。4 進め方、事例
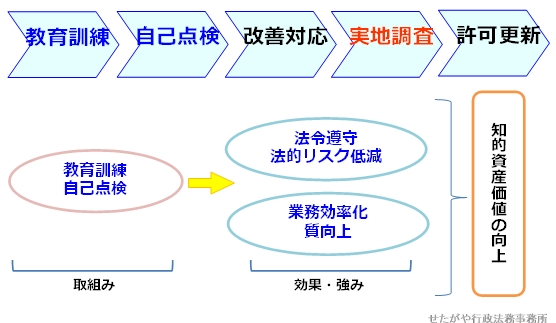
進め方の一例。
実際には,実地調査後に,都道府県による改善指導を受けて改善を実施する場合もあります。
実地調査での「不適合」などの改善指導を減ずるべく、事前の見直しがお勧めです。事業者様、担当者様の不安点
更新に向けた準備などをご依頼いただく中で、よく、担当者様が、「QMSなどの理解が十分でない」と自己認識されていらっしゃるケースがあります。
また、前任の担当者が退職し、手順書の内容が自分では理解できない、手順書と記録類(運用)が一致していない、ということでお困りの方もよくいらっしゃいます。
このような場合、都道府県の実地調査に対する不安が大きく、実際、直前の準備や、改善指導などで苦労されることも少なくないようです。
手順書運用等が不十分であれば、行政指導、あるいは回収などの事業リスクにつながってゆきます。
事業者としては、スムーズに調査を受審できることはもちろんですが、当事務所では、現場担当者の方の不安をできるだけ減らし、また、一緒に考えてゆければと考えています。そこで、1つの案として、次のような進め方をご提案させていただいています。
 現状把握 -現在の課題の確認
現状把握 -現在の課題の確認  教育訓練の実施 -不明点、不安点の解消と、知識のインプット
教育訓練の実施 -不明点、不安点の解消と、知識のインプット 自己点検 → 改善
自己点検 → 改善 実地調査受審
実地調査受審これはあくまでも例です。
実際には、お客様にあわせて、必要なことを適宜アレンジして進めさせていただいています。5 当事務所のサポート内容
一例です。
適宜、ご要望に応じてアレンジ致します。 薬事許認可・QMS・GVPレクチャー
薬事許認可・QMS・GVPレクチャー
 QMS・GVP 手順書・規定のチェック
QMS・GVP 手順書・規定のチェック QMS・GVP 第三者監査/自己点検実施サポート
QMS・GVP 第三者監査/自己点検実施サポート QMS・GVP 手順書作成/改訂
QMS・GVP 手順書作成/改訂 業許可更新申請
業許可更新申請 外国製造業者登録 更新申請
外国製造業者登録 更新申請 貴社のご要望に応じた教育訓練
貴社のご要望に応じた教育訓練(※行政書士でない個人や会社は、更新申請書の作成を業として行うことが出来ません)
など。
数人で事業をされている小規模事業者様から、大きな組織体をもつメーカー様まで、また東京近辺のみならず北海道、東北、中部、関西、四国、九州、沖縄に至るまで、各地で薬事コンサルティングの支援経験を生かして、対応させていただいています。


